Pesquisa investiga se os mecanismos de defesa produzidos por este tipo de leucócito podem estar relacionados com a resposta de pacientes oncológicos a diferentes tratamentos, como quimioterapia e imunoterapia.

N
ão é novidade que o sistema imunológico, composto por células de defesa especializadas, tem papel crucial na proteção do organismo contra células anômalas e patógenos (vírus, bactérias, fungos, protozoários e parasitas). Entre esses agentes protetores, os leucócitos, também chamados de glóbulos brancos, estão entre os principais protagonistas.
Por outro lado, nem sempre as ações de defesa dessas células – fagocitose, liberação de enzimas, produção de anticorpos, etc. – conseguem surtir o efeito esperado na resposta imune contra ameaças ao organismo. Na medicina oncológica, por exemplo, classes de leucócitos estão sendo investigadas devido ao seu papel na influência em tratamentos.
Esse é o foco de uma das pesquisas de João Paulo Mesquita Luiz, pós-doutorando da Faculdade de Medicina de Ribeirão Preto (FMRP-USP) em Imunologia e orientado pelo Prof. Dr. Fernando de Queiroz Cunha, ambos membros do Centro de Pesquisa em Imuno-oncologia (CRIO). “Estamos investigando se o nível de substâncias de defesa produzidas por neutrófilos (espécie de leucócito) presentes no sangue de pacientes oncológicos podem ser um marcador de resposta para diferentes tratamentos, como quimio ou imunoterapia”, diz.
Estreando a série “Imuno Foco”, apresentamos os responsáveis por cerca de 70% dos glóbulos brancos do sangue em humanos, com vida média de 7 horas e quantidade aproximada de 1.500 a 7.700 unidades por microlitro de sangue em um adulto saudável. Os guardiões do corpo humano, os defensores primários da imunidade: os neutrófilos.
Efêmeros, mas sorrateiros e destrutivos
Imagine um arranhão no seu dedão.
Quando o corpo é ferido ou enfrenta ameaças externas, as células danificadas do nosso organismo liberam substâncias químicas que alertam os agentes do sistema imune, desencadeando uma resposta inflamatória aguda. Os neutrófilos são os primeiros a chegar ao local da lesão pela corrente sanguínea, prontos para digladiar com os microrganismos invasores.
Ao identificar o patógeno, os neutrófilos liberam redes extracelulares de DNA, chamadas NETs (Neutrophil extracellular traps), que funcionam literalmente como armadilhas para imobilizar os invasores – qualquer semelhança entre os termos “rede” e “net” não é mera coincidência. Uma vez neutralizada, a célula inimiga é absorvida pelo neutrófilo – ou melhor, fagocitada – o qual libera espécies reativas de oxigênio para degradá-la.
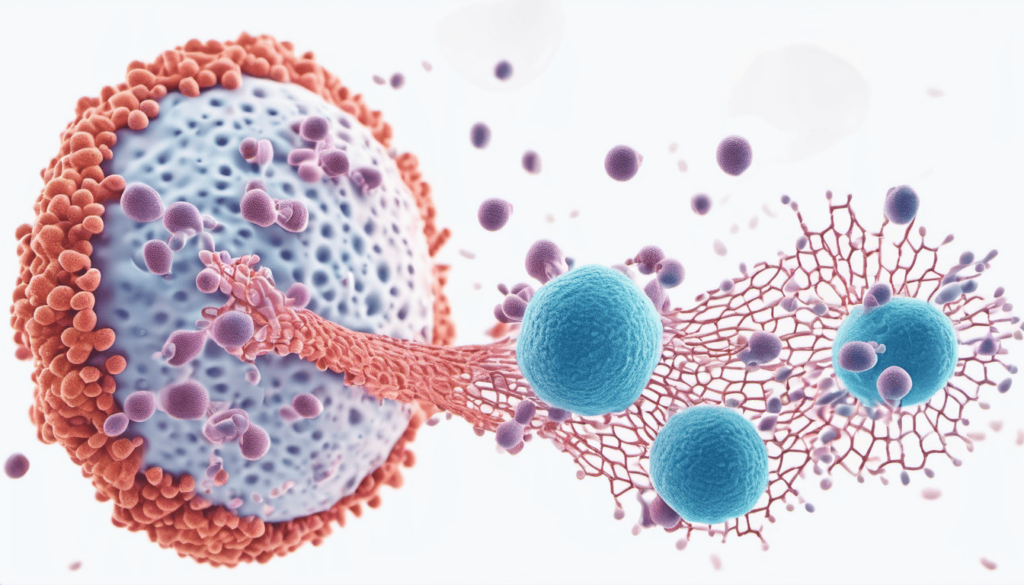
Concluído esse processo de controle dos invasores, o neutrófilo morre por apoptose (morte celular programada) e é absorvido por macrófagos dos tecidos adjacentes, companheiros de guerra cujo papel principal é limpar as células mortas do organismo e promover a renovação celular quando o corpo está livre de infecções ou inflamações.
Mas Luiz nos chama a atenção para um problema. Embora os neutrófilos e seus mecanismos de defesa sejam essenciais no combate a infecções na maior parte do tempo, a produção excessiva ou a não eliminação efetiva destas redes no organismo podem ter efeitos adversos – seus ataques desmedidos podem atingir órgãos saudáveis. Em casos de altos níveis de NETs, em vez de defenderem, elas podem estar associadas a doenças autoimunes e inflamatórias, além de terem possível influência no surgimento de diversos cânceres.
Quanto mais, nem sempre é melhor
Em condições normais de equilíbrio do organismo (homeostase), células com mutações são eventualmente geradas, mas posteriormente eliminadas por mecanismos de reparo de DNA e pela vigilância do sistema imunológico – como pelos próprios macrófagos. Essa “limpeza” reduz as chances de células defeituosas crescerem e se tornarem doenças, como o câncer. No entanto, devido ao declínio natural de nossa imunidade com o passar do tempo, conhecido como imunossenescência, o acúmulo de mutações ao longo dos anos pode aumentar a possibilidade de surgimento de doenças oncológicas.
Quando nossa homeostase é perturbada por patógenos ou agentes externos, como raios UV e poluentes, o organismo libera DAMPs (Padrões Moleculares Associados a Danos), desencadeando uma resposta inflamatória aguda liderada por neutrófilos e monócitos. No entanto, a exposição prolongada a esses agentes pode resultar em uma atividade desregulada de neutrófilos, causando danos nos tecidos e atrasando a cicatrização. Assim, a inflamação crônica ao longo do tempo pode danificar o DNA, aumentando o risco de câncer. Além disso, a incapacidade de eliminar as NETs pode contribuir para condições inflamatórias estéreis.
“Os neutrófilos criam armadilhas para capturar patógenos, mas entendemos que o excesso dessas substâncias pode ser prejudicial, mesmo que inicialmente tenham uma função positiva na captura de bactérias e vírus.
Apesar de evidências iniciais, alguns tratamentos mostram potencial na limpeza das redes de neutrófilos e na restauração da homeostase. Um estudo explorou o uso da hirudina, um anticoagulante que melhora o fluxo sanguíneo, auxiliando na eliminação das NETs. O tratamento com a enzima desoxirribonuclease (DNase), usada para modificar ou degradar o DNA em contextos médicos ou biológicos, também apresentou resultados promissores na quebra das redes de DNA liberadas pelos neutrófilos, reduzindo a inflamação e o risco de danos adicionais nos tecidos.
Por outro lado, o perfil dúbio das NETs quando analisadas sob a luz da oncologia, ainda tem sido alvo de preocupações entres pesquisadores. Trata-se de um campo de investigação recente e que tem gerado inúmeras indagações.
Aliados ou adversários na luta contra o câncer?
Os neutrófilos e suas armadilhas, em determinadas circunstâncias, podem ter papel pró ou antitumoral. Estudos indicam que as NETs não eliminadas podem ampliar o potencial metastático das células cancerígenas. Neste sentido, essas redes também já foram identificadas como possíveis alvos terapêuticos no tratamento de câncer, sendo a inibição da formação e/ou atividade das NETs nos tumores uma estratégia explorada, como previsto na pesquisa de Luiz.
Identificando as influências das NETs no organismo poderá, inclusive, ter implicações futuras nos tratamentos oncológicos. “Estabelecendo se a quantidade dessas moléculas no sangue pode ser considerada um indicador confiável da resposta de um(a) paciente frente a uma terapia, poderemos obter insights para aprimorar a personalização dos tratamentos contra o câncer”, comenta o cientista.
Assim, os próximos passos de Luiz envolvem promover investigações tanto em in vitro, com cultivo de células em laboratório, quanto em in vivo, com camundongos. A partir da observação de como as células cancerígenas se comportam diante das interações com as NETs no organismo, o cientista e sua equipe poderão trazer pistas importantes à investigação.
Sejam mocinhos ou vilões, os neutrófilos desempenham papel crucial na proteção do organismo contra ameaças. Contudo, as NETs, eficazes contra patógenos, podem virar-se contra o próprio sistema: uma faca de dois gumes. Pesquisas como as de Luiz são essenciais para aprofundar a compreensão das interações do sistema imunológico e reduzir as ambiguidades que, por vezes, surgem nesse micro universo em constante descoberta.
_____
Que saber mais?
🌐 Converse com os pesquisadores:
- João Paulo Mesquita Luiz
- E-mail: joaopaulomesquitaluiz@gmail.com
- Lattes: http://lattes.cnpq.br/5205243282238992
- LinkedIn: https://www.linkedin.com/in/joao-paulo-mesquita-a6968218a/
- ResearchGate: https://www.researchgate.net/profile/Joao-Paulo-Mesquita-Luiz
- Fernando de Queiroz Cunha (orientador e coordenador de subprojeto CRIO)
- E-mail: fdqcunha@fmrp.usp.br
- Lattes: http://lattes.cnpq.br/2869737621338203
